Collaboration entre STERIS VHP et ChargePoint : étude de cas : The Ritedose Corporation
Principaux points à retenir :
- Ritedose a utilisé la bio-valve ChargePoint AseptiSafe® Bio avec le système STERIS VHP™ pour le transfert de poudre stérile dans une salle blanche de classe C, évitant ainsi des mises à niveau coûteuses de l’infrastructure.
- Une réduction 6 log validée a été obtenue via un cycle en quatre phases (déshumidification, conditionnement, décontamination et aération), assurant la stérilité au point de transfert.
- La solution intégrée a éliminé le besoin d’isolateurs ou de systèmes RABS, réduisant ainsi les coûts, la consommation d’énergie et la complexité.
- Les méthodes de validation comprenaient des études d’indicateurs chimiques et biologiques, de remplissage des milieux et de maintien de la stérilité.
- Le système a amélioré l’efficacité des procédés, l’assurance de stérilité et l’ergonomie, démontrant des avantages évolutifs pour la fabrication pharmaceutique.
The Ritedose Corporation est une organisation nord-américaine de développement et de fabrication sous contrat (CDMO) qui produit des produits stériles en doses unitaires.
Ritedose est une société pharmaceutique qui offre un service complet et utilise la technologie de soufflage, remplissage et scellage. Ses capacités s’étendent bien au-delà de la fabrication, avec une équipe de développement interne spécialisée dans tous les aspects de la mise sur le marché d’un produit : lots à l’échelle du laboratoire, déclarations réglementaires, fabrication à grande échelle et distribution. Avec plus de 20 ans d’expérience dans la production de produits respiratoires et ophtalmiques, la société possède une usine d’une capacité de 1,7 milliard d’unités qui utilise les dernières technologies en matière de formulation, de soufflage, remplissage et scellage, et de conditionnement à haute vitesse.
Le défi
The Ritedose Corporation cherchait à résoudre les difficultés du chargement de substances actives stériles dans une cuve de mélange. Il s’agit d’un problème commun à tous les produits pharmaceutiques préparés de manière aseptique.
Point essentiel pour le procédé : le maintien de conditions de stérilité lors de l’arrimage d’un contenant sur la cuve et le transfert de la substance active à l’état solide pour former une suspension liquide. Avec un liquide complètement dissous, le produit pourrait être filtré pour garantir la stérilité lors du passage dans le système de remplissage. En l’occurrence, cependant, le produit transféré dans le système de remplissage était une suspension. Cette option n’était donc pas possible.
Il fallait donc que l’ensemble du procédé soit réalisé dans des conditions aseptiques. Pour cela, l’une des mises à niveau suivantes serait normalement nécessaire.
1. Faire passer l’ensemble de la salle blanche de la classe C à la classe A.
2. Transformer la salle en environnement de classe B et ajouter une zone de classe A surpressurisée autour du point de remplissage.
3. Transformer la salle en environnement de classe B et ajouter un système de barrières de sécurité (RABS) au point de remplissage ou à l’emplacement de la cuve pleine.
4. Maintenir la salle blanche à la classe C, mais introduire une technologie d’isolation autour du point de remplissage ou à l’emplacement de la cuve pleine.
Dans un cas pareil, les systèmes RABS et la technologie d’isolation auraient normalement été privilégiés, en raison des avantages qu’ils apportent en termes d’assurance de stérilité améliorée, par le biais de techniques fondamentales de séparation et de décontamination. Cela dit, compte tenu de certaines des contraintes négatives qui accompagnent ces technologies, telles que l’investissement en capital initial élevé, l’espace, l’ergonomie, ainsi que les coûts permanents et la consommation d’énergie, chercher une autre solution plus adaptée à cette tâche critique.
Solution
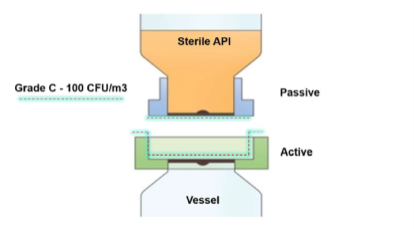
Le produit sélectionné comme solution idéale à ce problème est une bio-valve aseptique, qui assure un transfert étanche de la poudre, avec un faible encombrement, montée sur l’orifice d’entrée de la cuve. La valve peut être préstérilisée à la vapeur avec la cuve, contrairement aux vannes SBV traditionnels ou à d’autres raccords conventionnels (voir illustration 1a/b). Au raccordement final, cela a également permis d’éliminer tout risque de contamination de la salle depuis les faces d’accouplement du transfert, de manière contrôlée et validée (voir illustration 2a/b).

Illustration 1a : Raccord SIP à accouplement

Illustration 1b : Raccord SIP à vanne – Préstérilisation de la section active / cuve
Transfert de substance active stérile
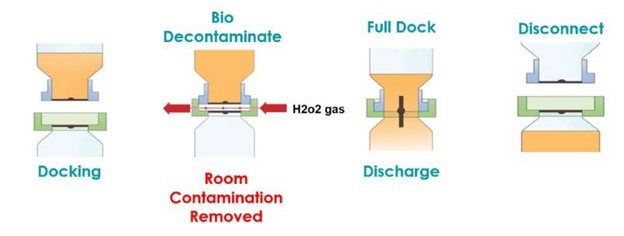
La bio-valve AseptiSafe crée une chambre étanche entre le contenant de transfert (section passive) et la cuve (section active). Lorsque les deux moitiés s’accouplent, la chambre scellée est alors bio-décontaminée avec un système de bio-décontamination au peroxyde d’hydrogène vaporisé (VHP®) de STERIS.
Illustration 2a

L’unité VHP de STERIS élimine toute contamination biologique, jusqu’à une réduction 6 log validée, et laisse l’espace et les faces d’accouplement décontaminées et prêtes à être complètement accouplées. Une fois les moitiés complètement accouplées, le disque peut être ouvert, ce qui permet de transférer le produit du contenant de transfert dans la cuve sans risque de contamination. La réalisation de ce transfert dans l’espace de classe C présentait d’énormes avantages en termes de coût et de production, même si le procédé devait être entièrement validé pour s’assurer que les avantages initialement perçus pouvaient être prouvés.
Illustration 2b
Validation
La première étape de la validation microbiologique du procédé consistait à générer un cycle de décontamination validé pour la phase gazeuse du peroxyde d’hydrogène. Le procédé gazeux à sec de STERIS VHP comprend quatre phases distinctes, par lesquelles le générateur doit passer pour assurer que toutes les conditions critiques soient respectées et qu’un cycle validé soit réalisé à chaque fois. Les quatre phases sont minutées.
1 Déshumidification – la valve gazée réduit l’humidité à l’intérieur de la chambre pour fournir des conditions idéales pour l’élimination biologique.
2 Conditionnement – le VHP est introduit dans la valve et s’accumule jusqu’au niveau permettant d’obtenir une bonne décontamination.
3 Décontamination – la concentration de VHP est maintenue pour désactiver toute activité microbiologique à l’intérieur de la valve.
4 Aération – à la fin de la décontamination biologique, le VHP est retiré du système de sorte qu’il ne reste plus de résidus nocifs. Normalement, le niveau acceptable est de 1 ppm. Ici, on a cependant retenu 0,4 ppm niveau acceptable. Ritedose a utilisé une limite de résidus plus faible pour s’assurer qu’ils disposaient d’un système robuste et qu’il n’y avait aucun risque de contamination de leur produit par des résidus de gaz.
Le cycle de décontamination complet peut être réalisé en seulement quatre minutes, bien que 20 minutes soit une durée plus courante. Pour cette application, le procédé n’était effectué qu’une fois par jour. Pour garantir un cycle plus robuste, du temps supplémentaire a été ajouté à chacune des phases critiques, afin de confirmer la décontamination et de dégager le gaz du système. Cela a donné un cycle complet de 41 minutes (du conditionnement à l’aération).
Paramètre/Phase | Déshumidification | Conditionnement | Décontamination | Aération |
Durée, min | 10 | 0 | 6 | 25 |
Les cycles initiaux utilisaient des indicateurs chimiques (IC) pour déterminer la distribution de H₂O₂. Une fois des résultats IC satisfaisants obtenus, des indicateurs biologiques (IB) ont été introduits dans le procédé pour confirmer que le procédé a été réalisé avec succès. À la fin de chaque cycle, tous les IB et IC ont été recueillis. Les bandelettes IC ont ensuite été vérifiées pour évaluer le changement de couleur afin de garantir une distribution uniforme de la vapeur. Les IB ont été transférés dans un milieu de croissance approprié, en l’occurrence le Milieu de culture Spordex®, puis incubés entre 55 et 60 °C pendant sept jours. Ces indicateurs ont été observés quotidiennement pour vérifier l’absence de croissance microbienne.

Les critères d’acceptation du cycle étaient les suivants :
A) Toutes les bandelettes IC utilisées dans le cycle doivent avoir changé de couleur.
B) Les IB contrôlés positifs doivent démontrer une croissance.
C) Au moins un IB de chaque emplacement ne doit pas présenter de croissance.
Une fois le cycle développé, il a ensuite été exécuté en trois exemplaires pour obtenir la qualification de performances (QP) pour cet élément du procédé.
Afin de valider complètement le système, le procédé a été mis à l'épreuve avec plusieurs essais de milieux avant la validation. Ces tests de milieu réussis ont ensuite été reproduits sur trois cycles de milieu en QP. Le maintien de la stérilisation a été démontré à plus de 10 jours avec le produit transféré dans la cuve et la bio-valve maintenue en position fermée par interverrouillage. La période de maintien de la stérilisation a été démontrée pour la section passive (produit dans le contenant de transfert) pendant 48 heures, ce qui était plus que suffisant. On utilise normalement la moitié de cette durée au maximum.
Conclusion
L’installation est maintenant opérationnelle et en pleine production. Aux avantages initiaux observés au début du projet (faible coût d'équipement, encombrement réduit et facilité d'installation) viennent désormais s'ajouter une assurance de stérilité améliorée,la facilité d'utilisation pour les opérateurs et une maintenance réduite. Le système est simple à utiliser, facile à installer et à valider, et a assurément amélioré le procédé du client.
L’un des enseignements de ce projet concerne l’étape de distribution. Au moment de la validation, le système installé était une solution réutilisable entièrement rigide dans laquelle la substance active préstérilisée était fournie à Ritedose en sacs. Ces sacs ont été ouverts, puis subdivisés et distribués dans un isolateur aseptique vers le contenant de transfert préautoclavé et la section passive de la bio-valve. Il aurait été avantageux de stériliser le produit, le contenant et le raccord de transfert en une seule étape (irradiation gamma). Toutefois, cela n’a pas été possible en raison des contraintes liées à la stérilisation gamma des ensembles en acier inoxydable et en élastomère d’un seul tenant.
Cette solution est désormais disponible auprès de ChargePoint sous la forme d'un passif à usage unique (SUP) / ChargeBag® et pourrait être adoptée à l'avenir pour améliorer et rationaliser le procédé. Ainsi, l'ensemble du conditionnement (sachet et passif) peut être envoyé en stérilisation gamma, au lieu de subir plusieurs étapes individuelles de stérilisation et d'assemblage aseptique.
« Il était essentiel pour nous de choisir la solution adéquate pour ce projet : éviter toute contamination des produits, et des pertes coûteuses. Nous avons choisi la bio-valve de transfert ChargePoint AseptiSafe® Bio en raison de son assurance de stérilité accrue lors de la manipulation d’ingrédients sensibles tels que notre substance active. nous avons reçu un soutien considérable au cours du projet et bénéficions d’importantes réductions de coûts et d’une grande efficacité des procédés. »
Angie Koen, VP of Technical Services, The Ritedose Corporation.
Contenu suggéré
Guide de mise en œuvre d’un système VHP pour la bio-décontamination des installations
Sélectionner une technologie de décontamination : aérosolisée ou VHP
Les avantages de la décontamination au peroxyde d’hydrogène vaporisé
Inscrivez-vous à notre liste de diffusion pour recevoir les dernières nouvelles du secteur et les mises à jour des produits.
En cliquant sur S’abonner, vous confirmez que vous acceptez nos Conditions générales.



