Mythes courants : nettoyage désinfectant dans les environnements contrôlés
Principaux points à retenir :
- Les données de suivi environnemental ne sont pas toujours un indicateur fiable du risque de contamination, car elles ne représentent qu’un instantané dans le temps et peuvent ne pas avoir de corrélation avec l’exposition réelle du produit ou avec les performances du processus aseptique.
- Les résidus de désinfectant ne présentent pas de risque inhérent pour la qualité du produit, et la croyance selon laquelle les résidus abritent des micro-organismes viables manque de fondement scientifique ; une approche basée sur l’évaluation des risques devrait guider la gestion des résidus.
- La pulvérisation de désinfectants n’est pas automatiquement supérieure à l’essuyage ou au nettoyage à la serpillière, car l’efficacité dépend de l’obtention d’une couverture complète de la surface et l’action mécanique de l’essuyage peut favoriser l’élimination des microbes.
- L’utilisation de routine de désinfectants et de sporicides est essentielle pour maintenir le contrôle de la salle blanche, mais les hypothèses concernant leurs limites, telles que le développement de résistances ou l’interférence des résidus, doivent être évaluées de manière critique.
- Les stratégies d’application de désinfectant doivent être adaptées aux facteurs spécifiques à l’installation, y compris les types de surface, l’accessibilité de la zone et les tendances historiques du suivi environnemental, plutôt que de reposer sur des pratiques généralisées ou obsolètes.
Les mythes et les idées fausses abondent en matière de microbiologie, de la « règle des 5 secondes » pour manger des aliments tombés par terre à la croyance ancestrale selon laquelle il faut manger pour guérir d’un rhume et jeûner pour guérir de la fièvre. En ce qui concerne les salles blanches et la microbiologie pharmaceutique, certains « mythes » se sont ancrés dans les idées et ont même été approuvés par les organismes de réglementation. Par exemple, certaines autorités insistent encore sur la rotation des désinfectants pour empêcher le développement de souches bactériennes résistantes. L’objectif des auteurs du cet article est de s’appuyer sur la logique et la science pour dissiper certains mythes microbiologiques liés au nettoyage désinfectant les environnements contrôlés.
Certaines des croyances, pratiques et politiques douteuses que nous avons rencontrées sont présentées ci-dessous :
MYTHE : les données de suivi environnemental sont un prédicteur fiable des risques pour la qualité des produits.
RÉALITÉ : les données viables de suivi environnemental concernant les microbes reflètent généralement un instantané et représentent un état transitoire qui peut persister ou non. Il n’est pas toujours possible d’extrapoler la pertinence d’un seul point de données (c.àd., un seul échantillon de surface) au-delà des paramètres d’échantillonnage immédiats. Les auteurs ont été témoins de simulations de processus aseptiques contaminées (remplissage de milieu) où le suivi environnemental associé était entièrement propre (0 UFC). À l’inverse, nous avons vu des résultats de remplissage de milieu réussi alors que les données du suivi environnemental associé montraient une contamination anormalement élevée, plusieurs excursions de niveaux Alerte et Action. L’interprétation des données de suivi environnemental des salles blanches est une pratique très nuancée, qu’il est préférable de confier à du personnel bien formé, instruit et expérimenté.
MYTHE : les résidus de désinfectants séchés sur les surfaces comportent des risques inhérents pour la qualité des produits pharmaceutiques.
RÉALITÉ : dans de bonnes conditions, tout résidu de surface peut présenter un risque pour la qualité. La théorie selon laquelle les résidus de désinfectant peuvent abriter des micro-organismes viables est une croyance non prouvée et est plutôt contre-intuitive si l’on considère les besoins métaboliques pour la viabilité des micro-organismes. Une approche scientifique et basée sur les risques pour traiter les résidus de désinfectant, ou tout autre résidu de salle blanche, est la seule solution recommandable.
MYTHE : la pulvérisation de désinfectants sur les surfaces permet d’obtenir un pouvoir couvrant et une efficacité supérieurs à ceux du lavage ou de l’essuyage.
RÉALITÉ : la technique est importante ! Les désinfectants chimiques liquides agissent par contact direct avec les membranes cellulaires. La pulvérisation peut être efficace si elle permet d’obtenir une couverture contiguë. L’action mécanique de l’essuyage et du lavage a également des avantages supplémentaires. La comparaison des deux méthodes n’est pas un exercice clair et net. Les entreprises doivent tenir compte de nombreux facteurs pour déterminer le mode d’application optimal pour leurs processus et installations, y compris, mais sans s’y limiter, les matériaux de surface et la complexité, la taille et l’accessibilité des zones, et les résultats historiques de suivi environnemental. Une évaluation des risques formelle peut aider à déterminer la meilleure approche.
MYTHE : les récupérations de moisissures sur une surface dans le cadre du suivi environnemental nécessitent une action corrective impliquant l’utilisation d’un agent sporicide sur cette surface.
RÉALITÉ : comme indiqué ci-dessus, les résultats de suivi environnemental sont un aperçu à l’instant « T » et reflètent généralement des conditions transitoires. Compte tenu de l’intervalle de temps entre le prélèvement de l’échantillon et la réception des résultats (généralement 3 à 5 jours), de nombreuses activités se sont probablement déroulées dans cet espace : il n’est pas logique de réagir comme si les conditions étaient restées les mêmes. Souvent, la surface en question aura déjà été traitée par un détergent germicide ayant une efficacité fongicide. Mieux vaut prévenir que guérir : une enquête approfondie sur l’origine de la moisissure et la prévention de sa réapparition sont une meilleure approche et plus scientifiquement fondée.
Mythe : plus il y en a, mieux c’est
Lors de nombreuses visites d’installations biopharmaceutiques et de dispositifs médicaux, les auteurs ont observé des protocoles complexes mis en place pour désinfecter les surfaces des salles blanches, impliquant au moins 3 variétés de désinfectants et plusieurs types d’agents sporicides. À titre d’exemple, un certain nombre d’entreprises que nous avons récemment visitées en Amérique du Sud déploient de tels protocole complexes. Ces approches compliquées de la désinfection des salles blanches la rendent fastidieuse pour les employés qui effectuent les tâches, sans avantage supplémentaire en termes de contrôle de la charge microbienne. Le fait est que l’utilisation de routine d’un seul détergent germicide à large spectre, associée à l’utilisation périodique et ciblée d’un agent sporicide, est un protocole pleinement efficace pour obtenir un contrôle suffisant de la charge microbienne dans la grande majorité des environnements de salle blanche1.
Q : si un sporicide peut tout tuer, pourquoi ne pas simplement l’utiliser tout le temps ?
R : l’inactivation chimique des endospores bactériennes nécessite des formulations assez agressives, telles que des mélanges d’hypochlorite de sodium ou de peroxyde d’hydrogène PAA (acide peracétique/acétique). L’utilisation trop fréquente d’un sporicide à base d’oxydant peut entraîner des problèmes de corrosion dans la salle blanche ainsi que des problèmes d’exposition en matière de Qualité, Hygiène, Sécurité et Environnement (QHSE). Par conséquent, les sporicides doivent être utilisés judicieusement, la fréquence étant basée sur le risque et l’historique des récupérations de bactéries formant des endospores dans le cadre du suivi environnemental.
L’alcool est un autre agent des salles blanches qui n’est pas toujours utilisé correctement. De nombreux établissements n’utilisent que de l’alcool isopropylique à 70 % sur les éléments qui seront introduits dans l’environnement de la salle blanche, supposant qu’il est efficace contre les spores fongiques et bactériennes. Comme indiqué dans le tableau ci-dessous, il peut y avoir un effet sur les spores fongiques (étude de Time-Kill2), mais un véritable agent sporicide est nécessaire pour empêcher l’intrusion d’agents formant des spores dans la salle blanche.
Efficacité du mélange H2O2/PAA RTU contre les moisissures
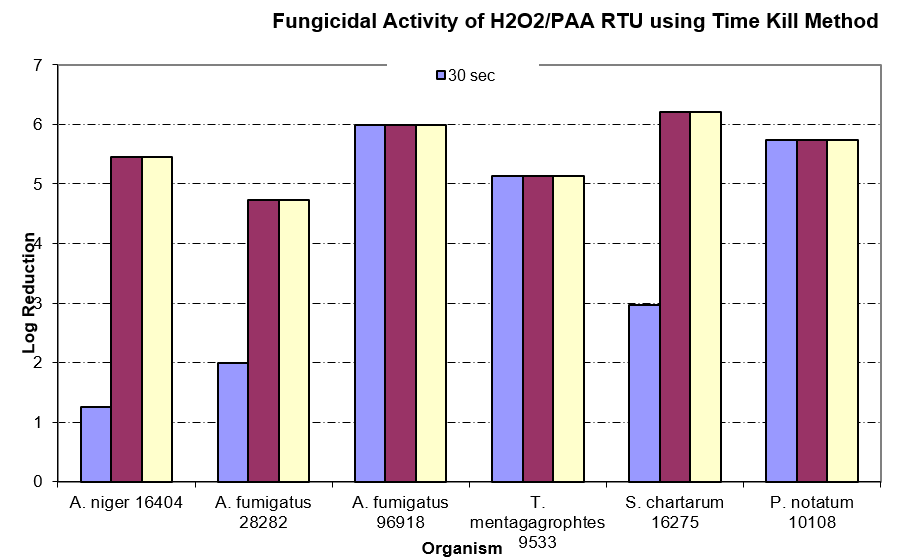
Souvent, les opérateurs sont formés avec des SOP et apprennent à réaliser des mouvements unidirectionnels qui se chevauchent avec des balais serpillière sur les murs et les sols... Cependant, cette technique peut être moins bien exécutée si la formation est insuffisante et que les pratiques ne sont pas appliquées. La préparation de dilutions adéquates pour l’utilisation est un autre élément clé d’une désinfection efficace3. Les éprouvettes graduées et les paquets de doses unitaires sont le moyen le plus précis. Il n’est jamais conseillé de verser un désinfectant concentré dans un seau en mesurant « à vue d’œil ».
Un programme de nettoyage et de désinfection efficace doit toujours comporter un désinfectant à large spectre et un sporicide contre les endospores bactériennes dans les salles blanches.

(Image Credit: http://www.pppmag.com/article/714/June_2010/Cleaning_Practices_for_Cleanroom_Contamination_Control/)
Mythe : les résidus de désinfectant abritent une charge microbienne et interfèrent avec l’efficacité d’un sporicide.
L’application systématique d’agents désinfectants et sporicides est nécessaire pour maintenir le contrôle environnemental des salles blanches. L’utilisation courante de ces produits peut laisser des résidus en surface. Des problèmes peuvent survenir en raison de l’utilisation de produits chimiques incompatibles en rotation, mais les résidus de désinfectant favorisent-ils à eux seuls la contamination microbienne ? Et les résidus de désinfectant interfèrent-ils avec l’efficacité sporicide ?
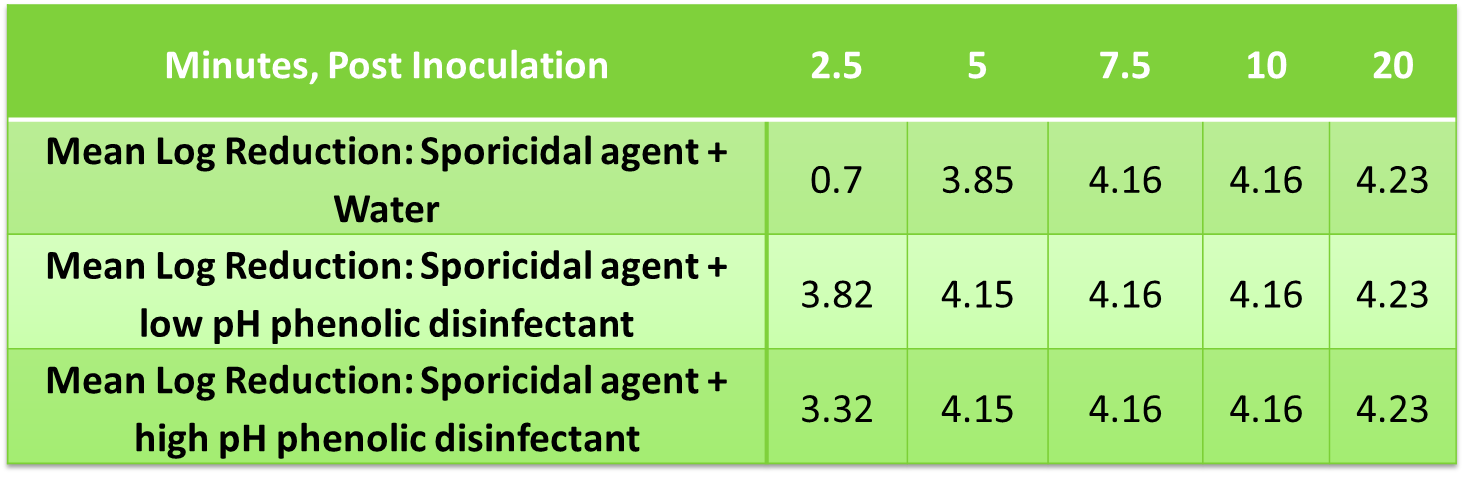
Les désinfectants phénoliques de nouvelle génération de STERIS ont été testés en tant que résidus dans une étude de temps de destruction afin d’évaluer l’impact sur l’efficacité d’un agent sporicide (SporKlenz® RTU) vs. Bacillus subtilis, ATCC n° 19659. Les solides (µg/cm2) de désinfectant séché ont été déterminés dans une étude distincte où la quantité de résidus a été calculée après plusieurs applications dans une éprouvette de test en acier inoxydable de 116 cm2 pour imiter une utilisation typique en salle blanche ainsi que la quantité de SporKlenz RTU pour couvrir une surface dans des applications typiques comme diluant. Dans le cas de ce dernier, il a été déterminé que 120 mg de stérilisant SporKlenz RTU couvraient une éprouvette de 116 cm2. Les rapports déterminés dans cette expérience ont été extrapolés pour déterminer la dilution du résidu de désinfectant à ajouter dans une solution d’agent sporicide.
Un volume de 0,1 ml de la suspension de micro-organismes a été ajouté à 9,9 ml de la solution de test (c.-à-d., l’agent stérilisant Spor-Klenz RTU enrichi avec un désinfectant phénolique à faible ou à fort pH). Un contrôle tampon a été enrichi en utilisant la même quantité. Après l’inoculation, un échantillon de 0,1 ml a été prélevé à 2,5, 5, 7,5, 10 et 20 minutes. Les échantillons ont été neutralisés, étalés et incubés pendant 48 à 49 heures à 37±2 °C. Le nombre d’organismes viables par ml d’échantillon a été déterminé par numération sur plaque aérobie standard.
Réduction logarithmique moyenne de B. subtilis obtenue au moyen de résidus phénoliques et d’une solution d’agent sporicide
De même, les résidus de désinfectant séchés ont été évalués pour déterminer leur impact sur l’efficacité sporicide, car cela reflète les pratiques typiques des salles blanches. Des échantillons ont été préparés pour représenter 20 jours d’application de désinfectant sur une zone connue, laissés à sécher, puis traités avec un volume d’agent sporicide suffisant pour couvrir la zone connue ou 8,6 µl/cm2. L’inoculum a été préparé à partir d’une suspension de spores de Bacillus subtilis, ATCC n° 19659. La suspension de spores de test a été diluée avec de l’eau DI à environ 3,0 x 108 UFC/ml. La suspension a été ajoutée à des tubes contenant des échantillons de test ou du tampon de Butterfields pour donner un mélange à 1 % v/v de micro-organismes dans le produit de test ou le tampon. À divers moments, les échantillons ont été neutralisés, étalés et incubés pendant 48 à 50 heures à 37±2 °C après l’inoculum. Le nombre d’organismes viables par ml d’échantillon a été déterminé par numération sur plaque aérobie standard et converti en valeurs log 10 à des fins d’analyse.
Réduction logarithmique moyenne de B. subtilis obtenue au moyen de résidus phénoliques séchés et d’une solution d’agent sporicide
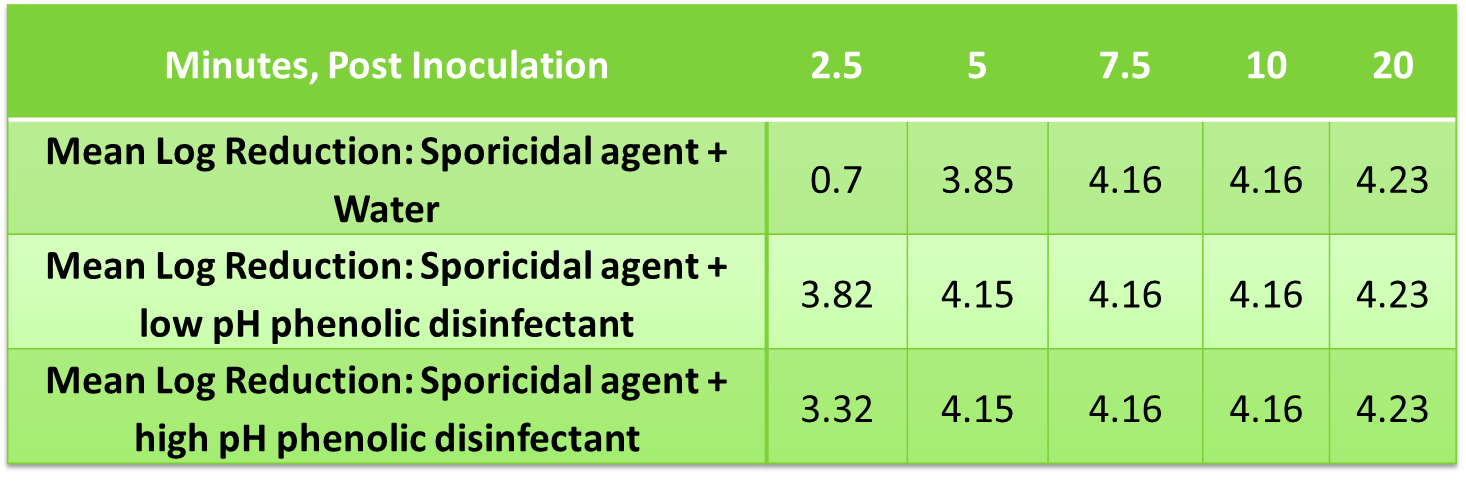
Les données ne montrent aucun effet inhibiteur/antagoniste du résidu séché ayant une efficacité sporicide.
Formation de base
Il est regrettable que, dans les secteurs biopharmaceutique, des doses orales solides et des dispositifs médicaux, les « équipes de nettoyage », responsables du nettoyage désinfectant des zones de production réglementées des salles blanches, reçoivent souvent le moins de formation, de conseils et de surveillance par rapport aux autres services (par ex., CQ, fabrication.). Souvent, par souci d’économie, le rôle du nettoyage désinfectant est relégué à une entreprise de nettoyage sous-traitante, ce qui complique encore les problèmes de formation et soustrait l’équipe de nettoyage de la surveillance du contrôle qualité et du contrôle qualité. Les heures de repos obscurcissent davantage ce qui se passe dans l’atelier. Dans le marché mondial actuel, il peut également y avoir des barrières linguistiques. Pour finir de compliquer la situation, le succès de la désinfection des surfaces et de l’environnement des salles blanches dépend entièrement des compétences et de la technique des opérateurs. Contrairement au nettoyage physique des souillures visibles, les surfaces des salles blanches semblent généralement déjà propres. Les employés sont ensuite chargés d’éliminer les matières invisibles, qu’il s’agisse d’une charge microbienne viable ou d’une contamination particulaire imperceptible. Il y a peu ou pas d’indices visuels qui indiquent si une surface a été efficacement décontaminée. C’est pour ces raisons que les opérateurs qui effectuent le nettoyage désinfectant doivent être exceptionnellement bien formés et familiarisés avec les principes de la microbiologie, du contrôle de la contamination et des pratiques aseptiques.
References:
- PDA Technical Report No. 70 (2015). Fundamentals of Cleaning and Disinfection Programs for Aseptic Manufacturing Facilities. Available from Parenteral Drug Association, Inc.
- Polarine, J., Macauley, J., Karanja, P., Klein, D., Martin, A. (2009) Evaluating the Activity of Disinfectants Against Fungi. Cleanrooms: The Magazine of Contamination Control Technology 23(2).
- http://www.pppmag.com/article/714/June_2010/Cleaning_Practices_for_Cleanroom_Contamination_Control/
Contenu suggéré
Un processus de nettoyage et désinfection justifié
Meilleures pratiques pour la validation des désinfectants dans les salles blanches
Élimination des résidus dans les salles blanches : un aperçu de la réglementation
Inscrivez-vous à notre liste de diffusion pour recevoir les dernières nouvelles du secteur et les mises à jour des produits.
En cliquant sur S’abonner, vous confirmez que vous acceptez nos Conditions générales.



