Pratiques d’inspection visuelle de l’équipement nettoyé
Principaux points à retenir :
- Une inspection visuelle est nécessaire pour confirmer que l’équipement est exempt de résidus visibles.
- La « propreté visuelle » est acceptée, mais les définitions varient si les procédures sont justifiées.
- Les surfaces de contact direct et indirect nécessitent des outils pour une inspection visuelle efficace.
- Les méthodes validées doivent permettre une inspection visuelle et garantir une propreté parfaite.
- Les seuils de visibilité définissent la détection de la contamination pour une inspection cohérente.
Les directives réglementaires et pharmaceutiques exigent que les fabricants confirment que l’équipement de traitement est propre sur le plan visuel après une opération de nettoyage. Récemment, une enquête de STERIS a montré que les pratiques d’inspection visuelle des équipements nettoyés diffèrent selon les fabricants. L’enquête a également indiqué que malgré les différences de pratiques et même de terminologie, ces pratiques peuvent être acceptées par les organismes de réglementation à condition que les processus soient bien documentés.
Tout d’abord, un mot sur la terminologie ; de nombreuses directives réglementaires et documents techniques de l’industrie utilisent des termes différents pour décrire l’étape de confirmation visuelle de la propreté de l’équipement de traitement après le nettoyage. Aux fins du présent article, les auteurs utilisent le terme « inspection visuelle ». Les autres termes courants pour cette étape sont « contrôle visuel » ou « examen visuel ». Notez que dans ce cas, le terme « inspection visuelle » ne fait pas référence à un contrôle visuel de l’absence de particules dans le produit fini.
39 fabricants ont répondu à l’enquête, représentant de nombreuses sociétés pharmaceutiques et biopharmaceutiques européennes (27 entreprises sur 34 sites différents). Les fabricants qui ont répondu à l’enquête produisent : pour 54 %, des produits non stériles (p. ex., comprimé, liquide, produit combiné), pour 13 %, des produits stériles (p. ex., produits issus de la biotechnologie, liquides et lyophilisés), pour 26 %, des vaccins, pour 5 %, des dispositifs médicaux, pour 2 %, d’autres produits (p. ex., production clinique précoce).
L’Annexe européenne 15 stipule qu’« un examen visuel de la propreté constitue une partie importante des critères d’acceptation de la validation du nettoyage »(1). L’inspection visuelle est une étape critique pour confirmer l’efficacité du nettoyage de l’équipement de traitement après le nettoyage. Le critère d’acceptation pour l’inspection visuelle est la propreté visuelle. L’inspection visuelle doit inclure les surfaces en contact direct et indirect avec le produit, et nécessite que les surfaces de l’équipement soient visibles. Lorsque ce n’est pas le cas, il peut être nécessaire de démonter l’appareil pour y accéder ou d’utiliser des outils tels que des miroirs, des sources de lumière ou des boroscopes (2, 3). Les technologies modernes telles que les caméras numériques capables d’évaluer la surface peuvent également être envisagées pour les récipients de grand volume lorsqu’une inspection visuelle est difficile.
La propreté visuelle est la norme minimale attendue. Un critère d’acceptation supplémentaire, tel que la limite basée sur les risques sanitaires, est toutefois appliqué (1-5). Par conséquent, une méthode d’analyse validée plus sensible que la limite de nettoyage doit être associée périodiquement à une inspection visuelle. Lors de l’application d’une inspection visuelle seule pour déterminer la propreté de l’équipement, il convient d’établir le seuil à partir duquel le produit est facilement visible sous forme de résidu (3, 6).
L’inspection visuelle est toujours effectuée (dans la mesure du possible) à la fin d’un cycle de nettoyage complet (7). L’inspection visuelle est une observation active et qualitative des surfaces en contact avec le produit afin de confirmer l’absence de résidus et que la production du prochain lot peut démarrer (7). L’ICH Q7 : Practice Guidance for Active Pharmaceutical Ingredients stipule que : « 12.76 ... Une inspection visuelle peut permettre la détection d’une forte contamination concentrée sur de petites surfaces, qui pourrait rester non décelée par échantillonnage et/ou par analyse. »
Pour en revenir à l’enquête, 54 % des participants déclarent effectuer une inspection visuelle de la surface de l’équipement lorsqu’elle est sèche (Figure 1).
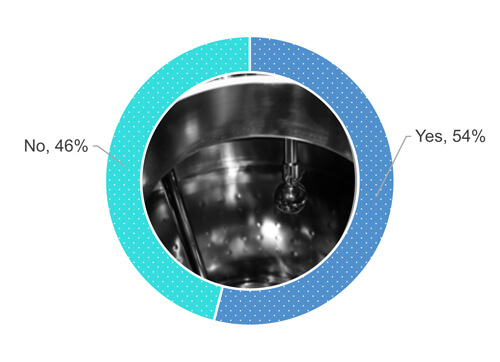
Figure 1 La procédure de votre entreprise exige-t-elle que vous inspectiez visuellement la surface de l’équipement de traitement après une opération de nettoyage, lorsque la surface est sèche ?
Certains documents techniques de l’industrie suggèrent d’effectuer une inspection visuelle sur une surface séchée, si possible, afin d’éviter des résultats faussement négatifs (8,9) :
Guide de l’Active Pharmaceutical Ingredients Committee (10) :
« Après l’exécution des procédures de nettoyage, l’équipement doit être séché pour permettre l’inspection visuelle. »
« Les critères d’acceptation pour le nettoyage de l’équipement doivent reposer sur le nettoyage visuel dans des conditions sèches et sur une limite analytique. »
PDA Technical Report No. 29 : Points to Consider for Cleaning Validation (9) : « D’ordinaire, les surfaces qui font l’objet d’un examen visuel doivent être sèches, car cela représente la condition d’inspection visuelle la plus défavorable. »
Il est bien connu que pour certains résidus, la propreté visuelle ne peut être atteinte que lorsque la surface est humide, alors que ce n’est plus le cas lorsque la surface sèche.
La conception de l’équipement et les paramètres du cycle de nettoyage peuvent conduire au séchage des surfaces de l’équipement, par exemple si la plomberie est inclinée vers l’orifice de vidange, si l’équipement est auto-vidangeable et si le rinçage final est effectué à des températures élevées. Dans certains cas, de l’air propre soufflé dans l’appareil et le système de distribution peuvent aider à sécher les surfaces (9).
Malgré le respect des paramètres énumérés ci-dessus, des gouttelettes ou de l’humidité (« transpiration ») à la surface peuvent être potentiellement observées et peuvent être acceptables si elles sont justifiées de manière adéquate.
Comme le montre la Figure 1, 48 % des 54 % participants qui ont répondu « oui » lorsqu’on leur a demandé s’ils inspectaient visuellement les surfaces de l’équipement lorsqu’elles étaient sèches procèdent à l’inspection visuelle sur des surfaces entièrement sèches (Figure 2). 24 % sur 54 % autorisent une certaine humidité partielle (par exemple, des gouttes isolées ou de la transpiration) des surfaces lors de l’inspection visuelle de l’équipement nettoyé (Figure 2). 19 % sur 54 % acceptent de nombreuses gouttes, mais pas d’accumulation d’eau. 9 % des 54 % n’ont pas défini les exigences de séchage.
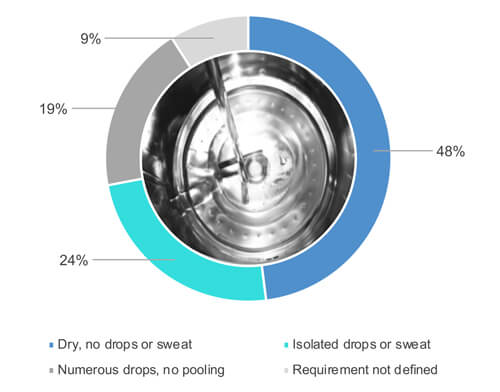
Figure 2 Quelle est l’exigence de séchage de l’équipement de traitement une fois le cycle de nettoyage terminé ?
Différents niveaux de séchage sont acceptables s’ils sont justifiés de manière adéquate et étayés par des données démontrant l’absence d’impact sur l’inspection visuelle après le nettoyage et la prolifération de la charge biologique pendant le stockage propre, par exemple, des instructions et une formation solides utilisant des photos pour éviter les écarts. Enfin, aucun des 54 % des fabricants qui inspectent visuellement leur équipement lorsque les surfaces sont sèches n’autorisent la présence d’eau stagnante ou l’accumulation d’eau sur les surfaces de l’équipement, comme le suggèrent le guide d’inspection de la FDA aux États-Unis (10) : « ... Par exemple, l’équipement doit être séché avant d’être stocké et en aucun cas de l’eau stagnante ne doit être autorisée à rester dans l’équipement après les opérations de nettoyage. » (traduction libre)
Une responsabilité considérable incombe à l’opérateur pour décider si les surfaces de l’équipement sont visuellement propres. Par conséquent, les opérateurs doivent être en mesure d’inspecter visuellement toutes les surfaces de l’équipement. Si ce n’est pas possible, des outils adéquats ou avancés doivent être disponibles pour garantir une prise de décision correcte (2, 3, 9, 11). L’inspection visuelle d’un grand récipient à travers un regard est restrictive en raison de la surface cachée. L’EMA suggère que la capacité d’inspecter visuellement l’équipement, telle que les distances observées sur le terrain, soit prise en compte dans un document de questions-réponses (3), recommandant que « des instructions écrites spécifiant tous les domaines nécessitant une inspection visuelle soient en place et [que] des registres clairs confirment que toutes les inspections sont terminées » (traduction libre). Enfin, des procédures détaillées et une formation sur les critères de propreté visuelle sont obligatoires pour garantir une prise de décision correcte. Le niveau de formation et de qualification pour effectuer une inspection visuelle doit être proportionné au risque de contamination croisée (3, 7, 9, 11).
En ce qui concerne les photos, 38 % des participants ont défini des critères de propreté visuelle en ajoutant également des photos et des exemples d’état de propreté (Figure 3). 46 % s’appuient sur la compréhension de la propreté visuelle par l’opérateur, associée à une définition théorique de la propreté visuelle dans la procédure. Enfin, 16 % (3 % et 13 %) s’appuient sur l’expérience et la formation de l’opérateur (à l’aide d’un support spécifique ou d’images) d’une surface visuellement propre (Figure 3).
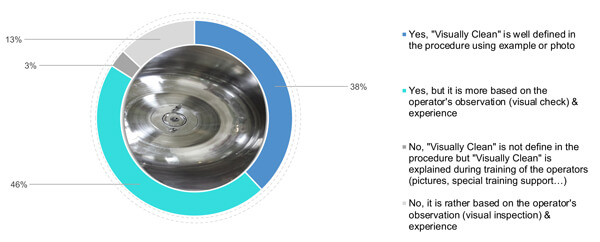
Figure 3 Votre entreprise définit-elle et précise-t-elle la signification des critères de « propreté visuelle » ?
Les opérateurs qui effectuent une inspection visuelle doivent recevoir une formation spécifique, car ce que l’on peut observer visuellement varie en fonction de la distance, de l’angle, de l’éclairage, de la nature de la surface, du degré de séchage et de l’acuité visuelle de la personne qui effectue l’inspection (3, 7, 9). L’EMA suggère que des tests de la vue (ou de l’acuité visuelle) soient effectués périodiquement et que la compétence de l’opérateur soit prouvée au moyen d’une évaluation pratique (3). Le guide Risk-MaPP de l’ISPE suggère que : « Lorsque la méthode de détection est uniquement visuelle, il est important de comprendre l’acuité visuelle du personnel et quel niveau de résidu est considéré comme sans danger (7). Si le niveau de sécurité est inférieur à l’acuité visuelle du personnel, le risque de non-détection d’une défaillance peut être considéré comme élevé, tandis que si le niveau de sécurité est largement supérieur (de plusieurs ordres de grandeur) à l’acuité visuelle du personnel, le risque de non-détection d’une défaillance peut être considéré comme faible. » (traduction libre).
La fréquence du test d’acuité visuelle et la limite d’acuité visuelle dépendraient de variables spécifiques telles que :
- la distance entre la personne effectuant l’inspection et la surface de l’équipement inspecté (3, 7, 12) ;
- la configuration de l’équipement et la nature de la surface (7,8) ;
- les conditions d’éclairage environnant (3, 7, 9, 12) ;
- la fréquence des tests analytiques (3, 7-9, 11,12) ;
- la toxicité des résidus, la limite de nettoyage par rapport à la limite de détection visuelle (3,6,7) ;
- l’exécution d’une inspection visuelle seule pour confirmer la propreté d’un équipement (7).
38 % des participants n’exigent pas de certification ou de qualification de l’opérateur (Figure 4). Pourtant, 49 % forment leurs opérateurs à la propreté visuelle sur le terrain (devant l’équipement). Enfin, 13 % qualifient leurs opérateurs.
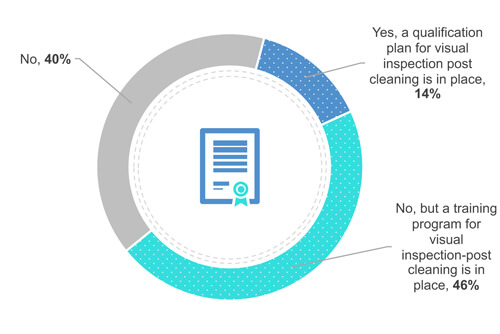
Figure 4 Votre entreprise dispose-t-elle d’un programme de certification ou de qualification en matière d’inspection visuelle ?
Certains fabricants ont défini la limite de résidus visuels, à l’aide d’éprouvettes, qu’un opérateur pourrait détecter (13, 14). En outre, certains d’entre eux ont reproduit la distance entre l’opérateur et les surfaces à inspecter sur l’équipement de traitement (15, 16). Lorsque la limite visuelle de résidus est inférieure à la limite de nettoyage, une simple inspection visuelle peut suffire (7) comme critère d’acceptation.
Une certification ou une qualification ainsi qu’un programme de formation garantissent-ils la compétence des opérateurs à inspecter visuellement une surface ? Conformément au précepte d’ICH Q9 : Quality Risk Management (17), la réponse dépendrait généralement :
- du nombre d’écarts historiques en matière d’inspection visuelle dus à la formation des opérateurs ;
- de la difficulté à inspecter l’équipement (configuration de l’équipement et environnement tel que l’éclairage, l’angle, etc.) (3, 7–9, 11, 12, 18, 19) ;
- du type d’inspection visuelle utilisé ; inspection visuelle qualitative ou quantitative (7, 12, 13–16, 18, 19) ;
- du fait que l’inspection visuelle n’est pas complétée par des tests analytiques (13–16, 18) ;
- de la fréquence des tests analytiques effectués avec une inspection visuelle ;
- de la sensibilité de la méthode d’analyse par rapport à la limite de nettoyage, de la toxicité (basée sur la limite d’exposition basée sur la santé) des résidus (1–7, 9, 11) ;
- de la présence d’un double contrôle.
Conclusion
Le concept d’inspection visuelle et les critères de « propreté visuelle » semblent varier selon les fabricants européens en fonction de leur expérience dans l’exécution du processus de nettoyage et de leur compréhension des exigences réglementaires. Toutefois, les critères de propreté visuelle doivent être clairement définis dans les procédures. Les opérateurs qui effectuent une inspection visuelle nécessitent une formation spécifique, qui peut être basée sur leur propre expérience.
La variabilité des pratiques entre les fabricants, comme le suggèrent les résultats de l’enquête, peut être acceptable lorsque le risque est documenté. Conformément aux préceptes de l’ICH Q9, le niveau d’effort et de formalité doit être proportionné au risque encouru par le patient.
La Partie II présentera une étude de cas et une suggestion d’exigences minimales pour l’inspection visuelle des surfaces nettoyées.
Pratiques d’inspection visuelle de l’équipement nettoyé: Partie II
Les fabricants européens interprètent les critères de « propreté visuelle » de diverses manières, en fonction de leur expérience dans l’exécution du processus de nettoyage et de leur propre interprétation des exigences réglementaires (1). Néanmoins, un programme formel de formation et de qualification en matière d’inspection visuelle et des instructions doivent être mis en place pour prévenir tout risque de contamination et vérifier que l’équipement est nettoyé conformément à l’ensemble de contrôles du fabricant (2).
La variabilité des pratiques entre les fabricants est acceptable. Cependant, les opérateurs doivent être périodiquement formés et qualifiés pour savoir quand inspecter visuellement la propreté d’un équipement et comment faire la distinction entre les résidus de produit et les imperfections de surface qui peuvent avoir une incidence sur les critères de propreté visuelle. L’étude de cas ci-dessous illustre pourquoi cela est important.
Étude de cas : observation lors de l’inspection visuelle
Récemment, des inspecteurs de la FDA des États-Unis ont fait part d’une observation à un fabricant biopharmaceutique anonyme concernant les critères de propreté visuelle. Au cours d’une visite de l’atelier de l’entreprise, l’un des inspecteurs a vérifié la pièce en amont où se trouvaient deux cuves de fermenteur. Les cuves font partie d’un système fermé et sont nettoyées à l’aide d’un système de nettoyage en place (CIP) entièrement automatisé. Le cycle CIP de l’un des fermenteurs s’est terminé une heure avant que l’inspecteur n’entre dans la pièce en amont. L’inspecteur a examiné l’intérieur de la cuve à travers le regard, a observé quelques gouttelettes de condensation et a remarqué que les surfaces n’étaient pas brillantes. Cela n’a pas convaincu l’inspecteur que la cuve était « visuellement propre » (Figure 1).

Figure 1 Détection d’empreintes chimiques (traces de décoloration) sur la surface intérieure du fermenteur
Cela a conduit à l’observation suivante : « Une décoloration a été observée dans le fermenteur (ID d’équipement XXXX). Ce problème spécifique n’a pas été évalué par l’entreprise. Ce fermenteur est utilisé pour la fermentation du [nom du produit] ». [Note de la rédaction : les citations traduites sont tirées du document réglementaire résultant de l’observation.]
Cette observation a soulevé beaucoup de questions et a eu un impact sur plusieurs stratégies de contrôle. Étant donné qu’elle s’est produite après un cycle de nettoyage au cours duquel une inspection visuelle systématique (de routine) a été effectuée, elle a affecté la stratégie de contrôle du nettoyage et le programme de maintenance en place pour s’assurer que les surfaces des récipients étaient dans un état acceptable. Ces deux programmes n’étaient pas alignés sur la façon d’inspecter et de gérer les cuves. Quoi de plus pratique qu’une inspection visuelle quotidienne pour confirmer un état de surface acceptable avant de confirmer l’état de propreté visuelle ?
La société biopharmaceutique a été en mesure de justifier la présence de gouttelettes après la fin du processus CIP comme acceptable, principalement parce que le temps de maintien de la propreté (CHT, clean hold-time) a été validé avec succès dans des conditions de nettoyage similaires. L’inspecteur a compris la situation (à savoir que l’équipement a été observé immédiatement après le processus de CIP) et a accepté la justification.
En ce qui concerne la décoloration de la paroi de la cuve, il y avait aussi une explication. Diverses conditions peuvent entraîner une décoloration de l’acier inoxydable lorsqu’il est en contact avec des produits spécifiques, des agents chimiques ou des effets thermiques. C’est ce qu’on appelle l’effet d’altération interne de la surface. Le changement de la surface peut modifier les conditions de l’inspection visuelle, ce qui peut influencer la décision d’un inspecteur (ou d’un opérateur) quant à savoir si la surface est propre sur le plan visuel, même si le fabricant dispose d’un processus de formation et de qualification de haute qualité.
L’observation en elle-même est claire : la « décoloration… n’a pas été évaluée » alors que l’équipement était utilisé régulièrement pour produire des produits biologiques en vrac. Elle ne faisait toutefois pas référence à une exigence spécifique.
Comment l’entreprise a-t-elle réagi à cette observation ?
- L’entreprise a reconnu qu’une décoloration de la surface avait été détectée lors de l’inspection de la FDA et n’avait pas été évaluée avant celle-ci.
- Une action immédiate a été mise en œuvre pour étudier la décoloration, des échantillons ont été prélevés à des fins d’analyse et le fermenteur n’a pas été utilisé.
L’enquête a démontré que la décontamination des récipients à l’aide d’agents caustiques ou d’autres agents chimiques à des températures élevées (supérieures à 100 °C) entraînait un stress des parois des cuves et pouvait provoquer l’apparition d’une réaction chimique sur les surfaces en acier inoxydable. L’électro-polissage ne restaure que temporairement la surface des récipients. En effet, les processus de décontamination et de nettoyage ont depuis généré des décolorations sur les surfaces internes du fermenteur.
Il y a une leçon à tirer de cette observation de la FDA : la portée de l’inspection visuelle par un inspecteur (par exemple, des opérateurs ou des techniciens) après un processus de nettoyage doit être bien définie. Les processus de décontamination et de nettoyage ont un impact durable sur la structure de l’équipement au fil du temps. Les processus en place pour le nettoyage, la décontamination et la maintenance doivent être cohérents, alignés et échelonnés. Par conséquent, la stratégie de contrôle du nettoyage et de la maintenance doit pouvoir relever les défis suivants :
- Comment évaluer et documenter les « imperfections visuelles » du matériel qui constitue l’équipement ?
- Comment définir adéquatement un niveau de séchage acceptable avant l’inspection visuelle ?
- Comment former les inspecteurs (opérateurs, techniciens et experts en la matière) au nettoyage visuel et aux imperfections de surface acceptables ?
- Comment définir une imperfection de surface qui entraînerait la disqualification de l’équipement ?
- Comment déterminer si le rôle de l’inspection visuelle doit inclure le contrôle des imperfections de surface ?
Procédure de vérification de l’état de propreté visuelle
La plupart des inspecteurs (opérateurs) de l’industrie inspectent et approuvent les équipements de fabrication sur la base de leur expérience (1,2). Pourtant, il peut être difficile pour les opérateurs de distinguer les résidus de produit des imperfections de surface.
Pour résoudre ce problème, les opérateurs doivent être formés sur un équipement construit avec les mêmes matériaux et dans la même situation que celui qui présente le ou les résidus cibles qu’ils sont censés détecter visuellement. La procédure de formation et le support permettant d’assurer une inspection visuelle reproductible doivent contenir au moins les sections suivantes :
1 Définition des critères de propreté visuelle
La propreté visuelle, définie comme « l’absence de résidus visibles sur une surface », doit être correctement définie comme un critère d’acceptation de la procédure.
En plus des descriptions, des images (Figure 2) de surfaces visuellement propres lors d’une procédure ou d’un cours de formation constituent la meilleure option. L’inspection visuelle pourrait détecter bien plus que des résidus de produit.
Des études récentes ont démontré qu’il est important, pour l’inspection visuelle de la propreté des surfaces, de former l’inspecteur à la distinction entre les résidus sur la surface et les imperfections ou la décoloration non critiques de la surface (2, 3). Dans certains cas, les opérateurs pourraient être informés du niveau de décoloration ou d’imperfection qui est acceptable sur les surfaces, car certains considèrent que ce contrôle de surface fait partie du programme de maintenance ou d’ingénierie.
Le niveau de séchage acceptable de l’équipement ou la catégorie et les conditions de vidangeabilité pourraient faire partie de la définition ou être inclus dans une évaluation des risques du nettoyage.

Figure 2 Surfaces visuellement propres après un processus de nettoyage
2 Portée de l’inspection visuelle
Quelles sont les surfaces qui doivent être inspectées visuellement ? Toutes les surfaces de l’équipement qui sont en contact direct ou indirect avec le produit, les matériaux en vrac ou les matériaux intermédiaires doivent être inspectées visuellement. Dans la mesure où toutes les surfaces d’un équipement ne sont pas nécessairement visibles pour une inspection visuelle, la portée peut être adaptée au type d’équipement. Il convient de déterminer ce qu’il faut inspecter visuellement sur la surface et de quelle façon.
3 Conditions environnantes pour inspecter visuellement la propreté d’une surface
Les conditions entourant l’équipement à inspecter visuellement ont une incidence sur la capacité à détecter correctement les résidus, ce qui fait de cet environnement un élément important. La quantité de résidus détectables (limite de résidus visibles) dépend du produit et doit être définie au cas par cas ou selon l’approche de regroupement (2–6).
Pour confirmer l’impact des conditions environnantes sur une inspection visuelle, les facteurs suivants doivent être analysés :
- Distance de visualisation : la distance entre la surface et l’opérateur. Il peut être difficile de simuler cette distance de visualisation en laboratoire ; cependant, le bon sens veut que plus la distance est grande, plus l’inspection visuelle peut être difficile. L’acuité visuelle de l’inspecteur à une distance spécifique joue également un rôle.
- Niveaux d’éclairage (environ de 400 à 1 500 lux dans les salles blanches normales) : certaines études sur éprouvettes ont indiqué que des niveaux de lumière entre 200 et 1 400 lux peuvent ne pas altérer l’inspection visuelle d’un inspecteur ; encore, cela doit être démontré par des situations réelles.
- Angle de vue : l’angle de vue entre les yeux de l’inspecteur et les surfaces à inspecter visuellement doit également être pris en compte et intégré dans le processus d’inspection visuelle. En fonction des angles et des niveaux d’éclairage, un inspecteur peut voir des reflets qui rendraient difficile de confirmer la propreté visuelle.
- Éclairage secondaire : l’utilisation d’une lampe de poche n’est pas recommandée si les cycles de validation du nettoyage n’ont pas été inspectés avec une lampe de poche. Les conditions d’inspection doivent être similaires entre les cycles de validation et le nettoyage/la maintenance de routine.
Il est essentiel de comprendre les facteurs environnants qui peuvent altérer l’inspection visuelle pour éviter des décisions inadéquates.
4 Planification de l’exécution de l’inspection visuelle
Une inspection visuelle doit être effectuée après une opération de nettoyage terminée. Cependant, elle ne fait souvent pas partie de la documentation, ce qui peut entraîner des questions sur la conduite de l’inspection visuelle effectuée en cas d’interruption d’un cycle de nettoyage. La procédure doit préciser combien de temps après la fin du cycle de nettoyage une inspection visuelle doit être effectuée. Ce moment doit être déterminé pour assurer la sécurité de l’opérateur lors de l’ouverture d’un récipient (par exemple, l’étape de rinçage est généralement effectuée à des températures élevées). Cette planification a un impact sur le processus de vidange de l’eau ou du solvant et peut invalider prématurément l’inspection.
5 Méthodologie d’inspection visuelle
Une méthodologie structurée pour inspecter visuellement la propreté de l’équipement doit être établie. Par exemple, un fabricant peut développer une liste de contrôle qui identifie les différentes parties de l’équipement à inspecter visuellement dans un trajet visuel cohérent. En plus de suivre la méthode d’inspection visuelle générale, certains fabricants ont développé des listes de contrôle identifiant les pièces spécifiques ou les endroits les plus graves connus qui doivent être inspectés visuellement.
6 Identification du ou des résidus visibles ciblés
Il convient de présenter aux opérateurs tous les éléments qu’ils sont susceptibles d’observer au cours de l’inspection visuelle. Ces éléments peuvent inclure les résidus de produit, les imperfections de surface, les dommages de surface, les résidus d’eau de particules, entre autres.
L’opérateur inspectera les surfaces visibles avec toutes leurs imperfections. Il sera également en mesure de détecter de nombreux autres éléments ou anomalies, à commencer par les défauts liés au matériau, à son vieillissement, aux traces de résidus d’eau, de particules et de produit (Figure 3). Par conséquent, la cible d’inspection visuelle et les critères d’acceptation doivent être clairement définis.

Figure 3 Éléments que les opérateurs doivent détecter sur une surface en contact direct ou indirect avec le produit
Le niveau de formalité associé à l’élaboration de ces six sections dépend des stratégies d’évaluation des risques et de contrôle de l’entreprise en matière de nettoyage.
Conclusion
L’inspection visuelle est la méthode idéale pour confirmer l’état de propreté visuelle. La plupart des inspecteurs (opérateurs) de l’industrie inspectent et approuvent les équipements de fabrication sur la base de leur expérience (1, 3). Sans une formation et une qualification adéquates, il peut cependant être difficile pour les opérateurs de distinguer les résidus de produit et les imperfections de surface. Par conséquent, il est logique de former correctement les opérateurs et de veiller à présenter tous les matériaux de construction et des situations similaires pour détecter visuellement le(s) résidu(s) cible(s) et les imperfections des surfaces qui pourraient avoir un impact sur l’état de propreté visuelle. Un programme formel de formation et de qualification en matière d’inspection visuelle ainsi que des instructions doivent être établis. Ce programme doit être basé sur l’ensemble de contrôles que le fabricant utilise pour vérifier que l’équipement est propre. Par conséquent, l’inspection visuelle telle que définie et qualifiée pourrait constituer une méthode de contrôle préliminaire dans le cadre d’une stratégie de gestion des risques liés au nettoyage.
Les deux auteurs ont participé à la rédaction du manuscrit et en ont approuvé la version finale. L’élaboration de cet article a été commanditée par GlaxoSmithKline Biologicals SA et STERIS. Les auteurs déclarent l’intérêt suivant : Walid El Azab est un employé de STERIS, Stéphane Cousin est un employé du groupe d’entreprises GSK.
Part 1 References
- European Commission, Good Manufacturing Practice Medicinal Products for Human and Veterinary Use: Annex 15, qualification and validation, 2015.
- Canada Health Products and Food Branch Inspectorate. Guidance Document. Cleaning validation guidelines: Drug and health products. Health Canada: Ottawa, Canada; 2002 Spring.
- European Medicines Agency, Questions and answers on implementation of risk-based prevention of cross-contamination in production and ‘Guideline on setting health-based exposure limits for use in risk identification in the manufacture of different medicinal products in shared facilities’ (EMA/CHMP/CVMP/SWP/169430/2012), EMA/CHMP/CVMP/SWP/246844/2018, (April 2018)
- European GMP part IV Guidelines on Good Manufacturing Practice specific to Advanced Therapy Medicinal Products
- Pharmaceutical Inspection Convention and Pharmaceutical Inspection Co-operation Scheme. Guide to Good Manufacturing Practice for Medicinal Products: Annex 15, 2015.
- Walsh A. et al., “Justification & Qualification Of Visual Inspection For Cleaning Validation In A Low-Risk, Multiproduct Facility.” Pharmaceutical Online (Aug. 3, 2018) accessed January 2020 https://www.pharmaceuticalonline.com/doc/justification-qualification-of-visual-inspection-for-cleaning-validation-in-a-low-risk-multiproduct-facility-0001
- ISPE, ISPE Risk-Based Manufacture of Pharmaceutical Products, second edition, Volume 7
- Active Pharmaceutical Ingredients Committee, guidance on aspects of cleaning validation in active pharmaceutical ingredient plants (2016)
- Parenteral Drug Association, Technical Report 29, Points to Consider for Cleaning Validation (2012)
- GUIDE TO INSPECTIONS VALIDATION OF CLEANING PROCESSES, accessed on September 2019: https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/inspection-guides/validation-cleaning-processes-793
- Parenteral Drug Association, Technical Report 49, Points to Consider for Biotechnology Cleaning Validation (2010)
- ASTM: E306-18, Standard guide for Science-Based and Risk-Based Cleaning Process Development and Validation, October 2018 version 1.
- Forsyth, R.J., et al. “Visible-Residue Limit for Cleaning Validation and its Potential Application in a Pharmaceutical Research Facility.” Pharmaceutical Technology 28 (Oct. 1, 2004) 68–72.
- “Application of Visible-Residue Limit for Cleaning Validation.” Pharmaceutical Technology 28 (Oct. 2, 2005) 10 http://www.pharmtech.com/application-visible-residue-limit-cleaning-valiation?id=&pageID=1&sk=&date= (accessed September 2019)
- “Determination of Surface Visible Residue Limits on Pharmaceutical Plant Equipment.” Pharmaceutical Technology 37 (Feb. 2, 2013)
- Desai, P., and Walsh, A. “Validation of Visual Inspection As An Analytical Method For Cleaning Validation.” Pharmaceutical Online (Sept. 11, 2017) https://www.pharmaceuticalonline.com/doc/validation-of-visual-inspection-as-an-analytical-method-for-cleaning-validation-0001 (accessed September 2019)
- International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for human use, Quality Risk Management Q9, (2005)
- Walsh, A., et al., “Justification & Qualification Of Visual Inspection For Cleaning Validation In A Low-Risk, Multiproduct Facility.” Pharmaceutical Online (Aug. 3, 2018) https://www.pharmaceuticalonline.com/doc/justification-qualification-of-visual-inspection-for-cleaning-validation-in-a-low-risk-multiproduct-facility-0001 (accessed January 2020)
- Forsyth, R.J., and Hartman, J., “A Risk-based Approach to Cleaning Validation using Visible Residue Limits.” Pharmaceutical Engineering 28 (2008) 8–22.
Part 2 References
- El Azab W. and Cousin S., “Visual Inspection Practices of Cleaned Equipment: Part I,” accessed April 2020: https://www.pda.org/pda-letter-portal/home/full-article/visual-inspection-practices-of-cleaned-equipment-part-i
- Walsh, A., et al., “Justification & Qualification of Visual Inspection for Cleaning Validation in a Low-Risk, Multiproduct Facility.” Pharmaceutical Online (Aug. 3, 2018) https://www.pharmaceuticalonline.com/doc/justification-qualification-of-visual-inspection-for-cleaning-validation-in-a-low-risk-multiproduct-facility-0001
- Desai, P. and Walsh, A. “Validation of Visual Inspection as an Analytical Method for Cleaning Validation.” Pharmaceutical Online (Sept. 11, 2017) https://www.pharmaceuticalonline.com/doc/validation-of-visual-inspection-as-an-analytical-method-for-cleaning-validation-0001
- Forsyth, R.J., et al. “Visible-Residue Limit for Cleaning Validation and its Potential Application in a Pharmaceutical Research Facility.” Pharmaceutical Technology 28 (Oct. 2004): 58–72 https://pdfs.semanticscholar.org/ea64/d01db84d3b8a5a62f1c824abf8484af363dd.pdf
- “Application of Visible-Residue Limit for Cleaning Validation.” Pharmaceutical Technology 29 (Oct. 2, 2005) http://www.pharmtech.com/application-visible-residue-limit-cleaning-validation?id=&pageID=1&sk=&date=
- “Determination of Surface Visible Residue Limits on Pharmaceutical Plant Equipment,” Pharmaceutical Technology (Feb. 2, 2013) 37 http://www.pharmtech.com/determination-surface-visible-residue-limits-pharmaceutical-plant-equipment?id=&pageID=1&sk=&date=
Contenu suggéré
Un processus de nettoyage et désinfection justifié
Services à prendre en compte lors de la validation de votre équipement
Préservation de l’acier inoxydable : la gestion de la rouille
Inscrivez-vous à notre liste de diffusion pour recevoir les dernières nouvelles du secteur et les mises à jour des produits.
En cliquant sur S’abonner, vous confirmez que vous acceptez nos Conditions générales.



